- 製品特徴
- 製品写真
- 製品情報

-

トリロスタブ®2.5
-

トリロスタブ®2.5
10錠×3シート化粧箱 -

トリロスタブ®5
-

トリロスタブ®5
10錠×3シート化粧箱 -

トリロスタブ®10
-

トリロスタブ®10
10錠×3シート化粧箱 -

トリロスタブ®30
-

トリロスタブ®30
10錠×3シート化粧箱 -

トリロスタブ®60
-

トリロスタブ®60
10錠×3シート化粧箱
-
成分及び分量
トリロスタブ2.5:本剤1錠中(約100mg)トリロスタン 2.5mg
トリロスタブ5:本剤1錠中(約100mg)トリロスタン 5.0mg
トリロスタブ10:本剤1錠中(約100mg)トリロスタン 10.0mg
トリロスタブ30:本剤1錠中(約200mg)トリロスタン 30.0mg
トリロスタブ60:本剤1錠中(約200mg)トリロスタン 60.0mg -
効能又は効果
犬:副腎皮質機能亢進症(クッシング症候群)に伴う諸症状の改善
-
用法及び用量
本剤の投与は体重1.7kg以上の犬を対象とし、初期投与量(下記「初期投与」参照)、減量、維持あるいは増量とも症状により適宜増減し(下記「初期投与終了以降」参照)、体重及び錠剤規格に基づき、本剤の至適投与量を食餌と共に経口投与する。
(1)初期投与(投与開始後10~14日目まで)
初期投与量(2.2~6.7mg/kg)を1日1回、食餌と共に経口投与する。その際、各種錠剤規格を組み合わせ、体重に基づき可能な限り低い投与量から開始する。
(2)初期投与終了以降
投与開始後10~14日目に、モニタリングとして生理学的検査、血液学的検査、血液生化学的検査及び臨床症状の観察を行うとともに、ACTH刺激試験(注1)によりコルチゾールを測定する。その際、ACTH投与後のコルチゾールの値や臨床症状に基づいて、「投与量の増減基準」(表)を参考に、本剤の減量、維持あるいは増量を行い至適投与量(注2)を決定する。なお、至適投与量はモニタリングの結果を総合的に判断し、個体毎に適宜増減する。また、投与量の増減を行ってから10~14日目に経時的にモニタリングを行い、至適投与量に到達した後も約30日毎のモニタリングを行う。
なお、コルチゾール及び臨床症状の改善がみられない場合は、1日の投与量を2回に分けて投与する方法(1日2回投与)で追加増量を行う。注1 ACTH刺激試験
①本剤の投与後4~6時間(できれば午前中)、試験前は安静、絶食、自由飲水とする。
②合成ACTH製剤の投与前の血液を採取する。
③合成ACTH製剤を0.25mg/頭の用量で静脈内(又は筋肉内)に投与する。ただし、5kg未満の小型犬では、0.125mg/頭とする。
④合成ACTH製剤の投与後1時間に血液を採取する。
⑤合成ACTH製剤の投与前及び投与後1時間の血液試料におけるコルチゾールを測定する。
注2 至適投与量の指標
ACTH刺激試験でのコルチゾールが1.45μg/dL~9.1μg/dLの範囲(基準値)、あるいは臨床症状の改善がみられた投与量。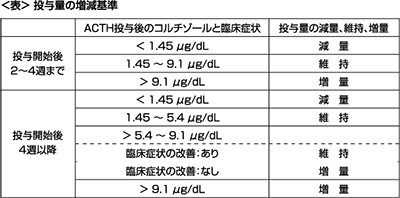
(3)投与中止・中止時の臨床的措置・再開
ACTH刺激試験でコルチゾールの反応低下(< 1.45μg/dL)がみられた場合、及び副腎皮質機能低下症(アジソン病)に特徴的な電解質異常(低ナトリウム血症及び高カリウム血症)がみられた場合は、本剤の投与を中止する。
本剤の投与を中止する際、副腎皮質機能低下症(アジソン病)の対症療法として、副腎皮質ホルモン[コルチゾール及びコルチコステロン(糖質コルチコイド)、アルドステロン(電解質コルチコイド)]等のホルモン補充療法、ならびに電解質輸液療法を行う。
本剤の投与を中止した後、ACTH刺激試験でのコルチゾールがおおよその目安として1.45μg/dL以上に復帰するか、又は、副腎皮質機能亢進症の臨床症状が再発した場合、本剤の投与を再開する。その際、生理学的検査、血液学的検査、血液生化学的検査及び臨床症状の検査を行うとともに、ACTH投与後のコルチゾールの値を確認し、低用量から投与を再開する。 -
有効期間
36カ月
- ※使用前に必ず添付文書を読み、注意事項を守って使用してください。

